Структурная биология SARS-CoV-2: рентгеновская кристаллография
Дата публикации: 07-08-2021
Обновлено: 16-05-2025
Тема: Covid-19
Время чтения: 1 мин
Автор статьи
Eufemia PutortiМедицинский редактор
Massimo Degano
Редактор и переводчик
Viktoryia LuhakovaПродолжающаяся пандемия COVID-19 сподвигла научное сообщество посвятить себя исследованию и разработке различных стратегий борьбы с инфекцией SARS-CoV-2. Единственный способ выявления новых противовирусных препаратов — это знание трехмерной структуры, буквально формы вирусных белков, которые ответственны за клеточную инфекцию и репликацию вируса. Как только структура белков известна, химики могут синтезировать соединения, которые блокируют функцию белков и, следовательно, жизненный цикл вируса.
Мы поговорили об этом с доктором Массимо Дегано, руководителем группы биокристаллографии госпиталя Сан-Раффаеле и профессора в Университете Vita-Salute San Raffaele.
В предыдущих статьях мы объясняли, что для разработки лекарств против SARS-CoV-2 необходимо очень подробно знать структуру белков вируса, которые мы выбрали в качестве мишени, исходя из их важности для жизненного цикла вируса. Это задача структурной биологии, и мы уже объяснили принцип работы электронной криомикроскопии. Первым методом, который позволил визуализировать структуры молекул с атомной детализацией является рентгеновская кристаллография.
Успехи рентгеновской кристаллографии
Теория кристаллографии была разработана вскоре после того, как Вильгельм Рентген открыл рентгеновские снимки, благодаря вкладу Макса фон Лауэ (лауреата Нобелевской премии 1914 года) и Уильяма Генри и Уильяма Лоуренса Брэгга (отец и сын, оба получили Нобелевскую премию 1915), которая на протяжении многих лет постоянно совершенствовалась. Если во времена пионеров теории кристаллографии определение структуры малых молекул, таких как аспирин, было сложной задачей, то благодаря новаторам (сэру Джону Кендрю и Максу Перуц) удалось определить первые структуры целых белков, миоглобина и гемоглобина. С 1945 года по сегодняшний день список успехов кристаллографии в предоставлении изображений белков, представляющих биомедицинский интерес, бесконечен. Важность этой информации подтверждается Королевской академией наук Швеции, которая регулярно награждает структурные исследования, которые позволяют нам понять функционирование сложных белков (https://www.iucr.org/people/nobel-prize).
Рентген для визуализации структуры больших молекул
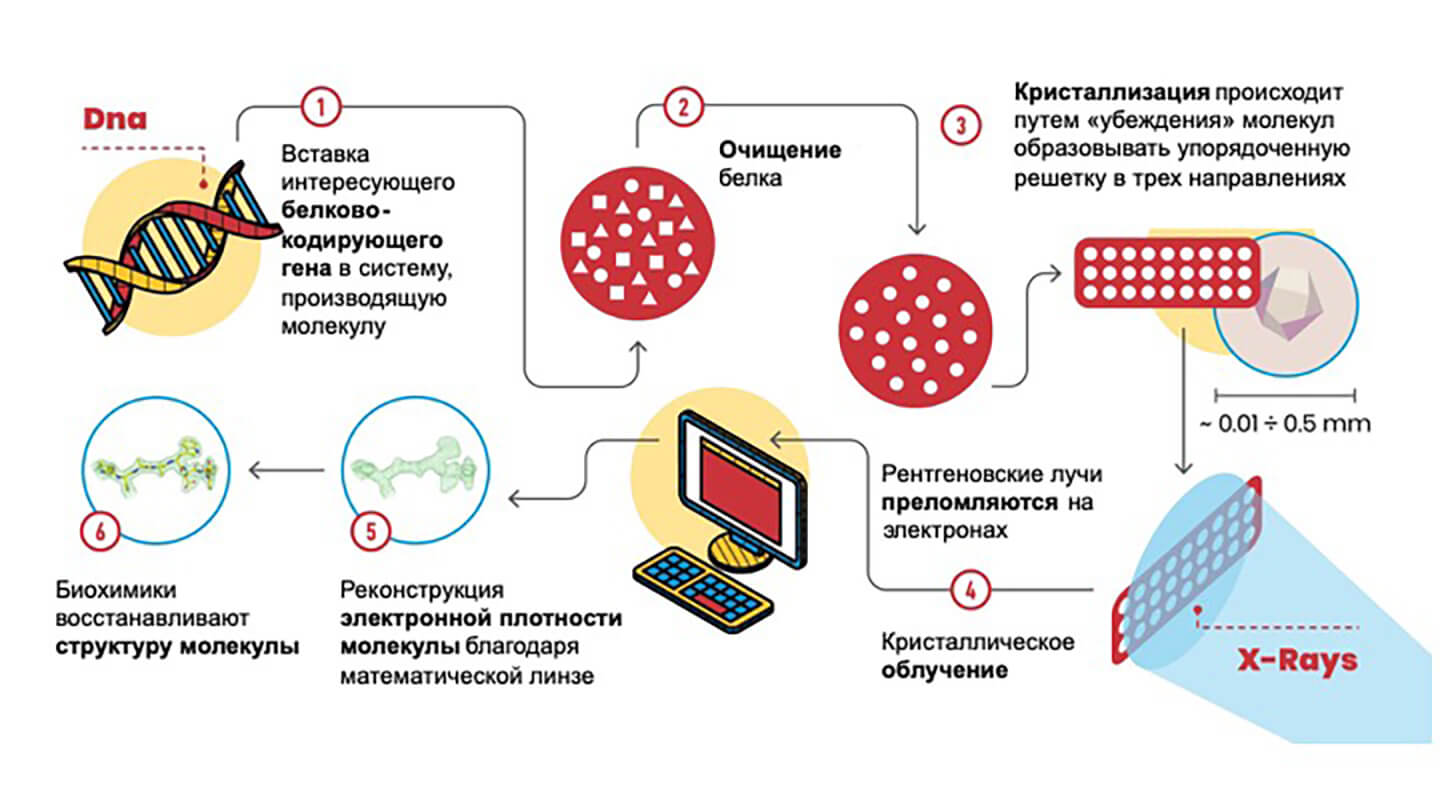
Каковы этапы этой техники? Давайте посмотрим на схему:
1, 2. Необходимо иметь в наличии миллиграммы чистого образца, то есть бесконечно малые количества загрязняющих веществ – другими словами много одинаковых молекул.
3. Далее эти молекулы должны сформировать кристалл, то есть упорядоченную трехмерную решетку. Этот шаг является фундаментальным, потому что молекулы в кристалле расположены в соответствии с симметричными схемами, такими как те, которые изучал М. С. Эшер .
4. Порядок молекул в кристалле при облучении рентгеновскими лучами, заставляет электроны вокруг атомов дифрагировать фазовое излучение, складываясь как составляющие хор голоса. Этот эффект усиления позволяет нам измерять дифракционный спектр, то есть направление распространения и интенсивность дифрагированния рентгеновского излучения, молекулами в кристалле.
5. Как только это измерение выполнено, применяя своего рода математическую линзу (называемую «обратное преобразование Фурье»), мы получаем электронную карту плотности, которая демонстрирует расположение атомов в кристалле. Электронную плотность можно увидеть на компьютере, в нее необходимо вставить компоненты изучаемой биологической молекулы (аминокислоты для белков, рибоза и азотистые основания для ДНК и РНК…). Этот процессе многим может напомнить видеоигру.
6. Завершив интерпретацию электронной плотности, мы наконец получили трехмерную структуру.
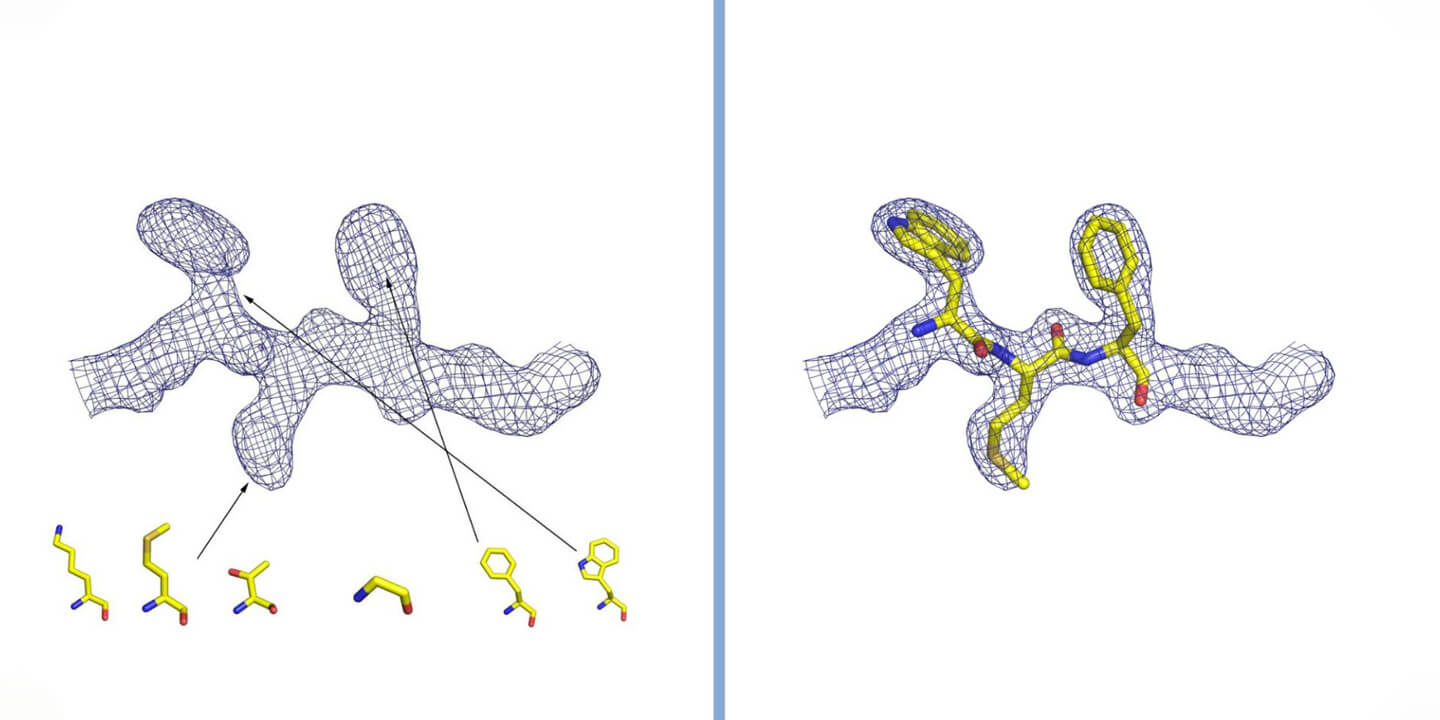
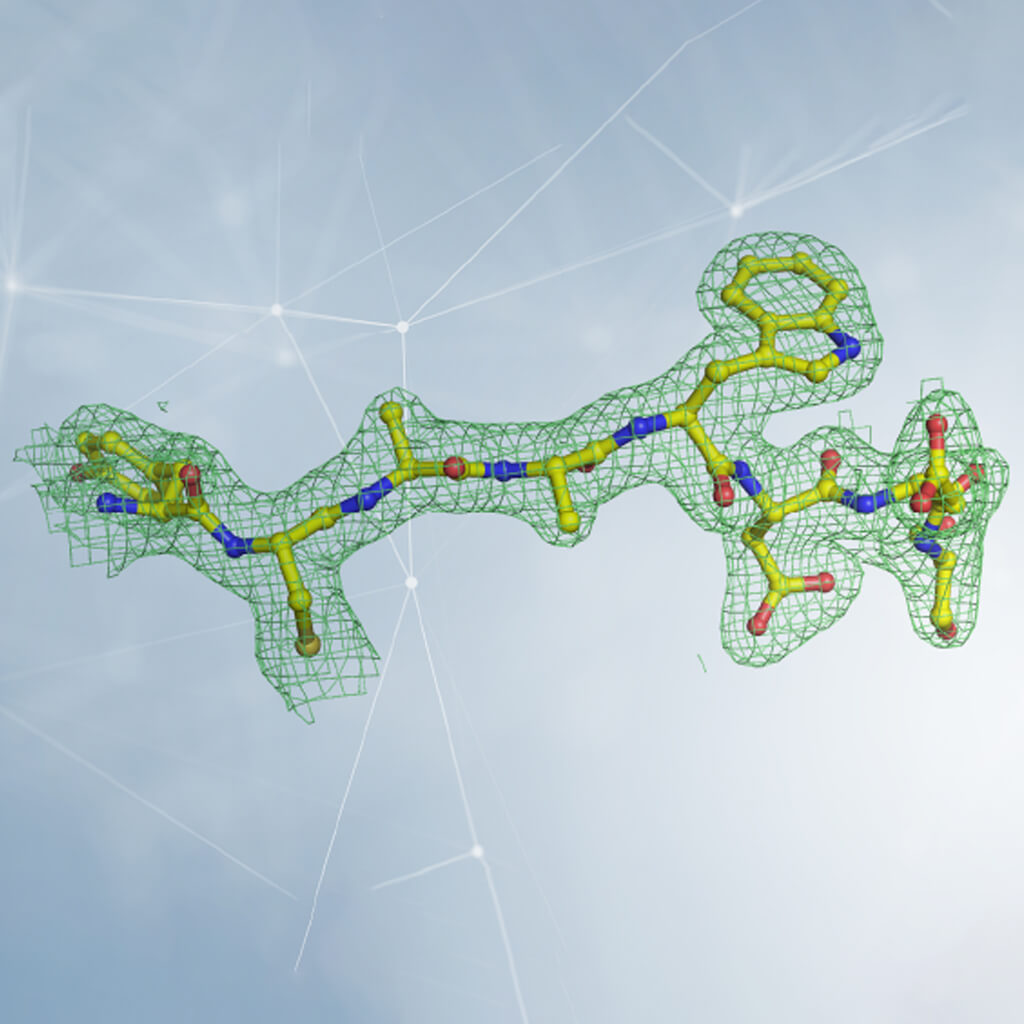
Интерпретация электронной плотности в кристаллографии. Плотность представлена сеткой, внутри которой расположены атомы, из которых состоит белок. В случае белка, плотность наблюдается и сравнивается со структурой двадцати аминокислот, которые его составляют (некоторые из которых представлены на рисунке). Вставляя аминокислоты в правильном порядке и следуя трехмерной структуре выявленной при измерениях электронной плотности, происходит реконструкция структуры белка. Предоставлено доктором Дегано.
Использование кристаллографии
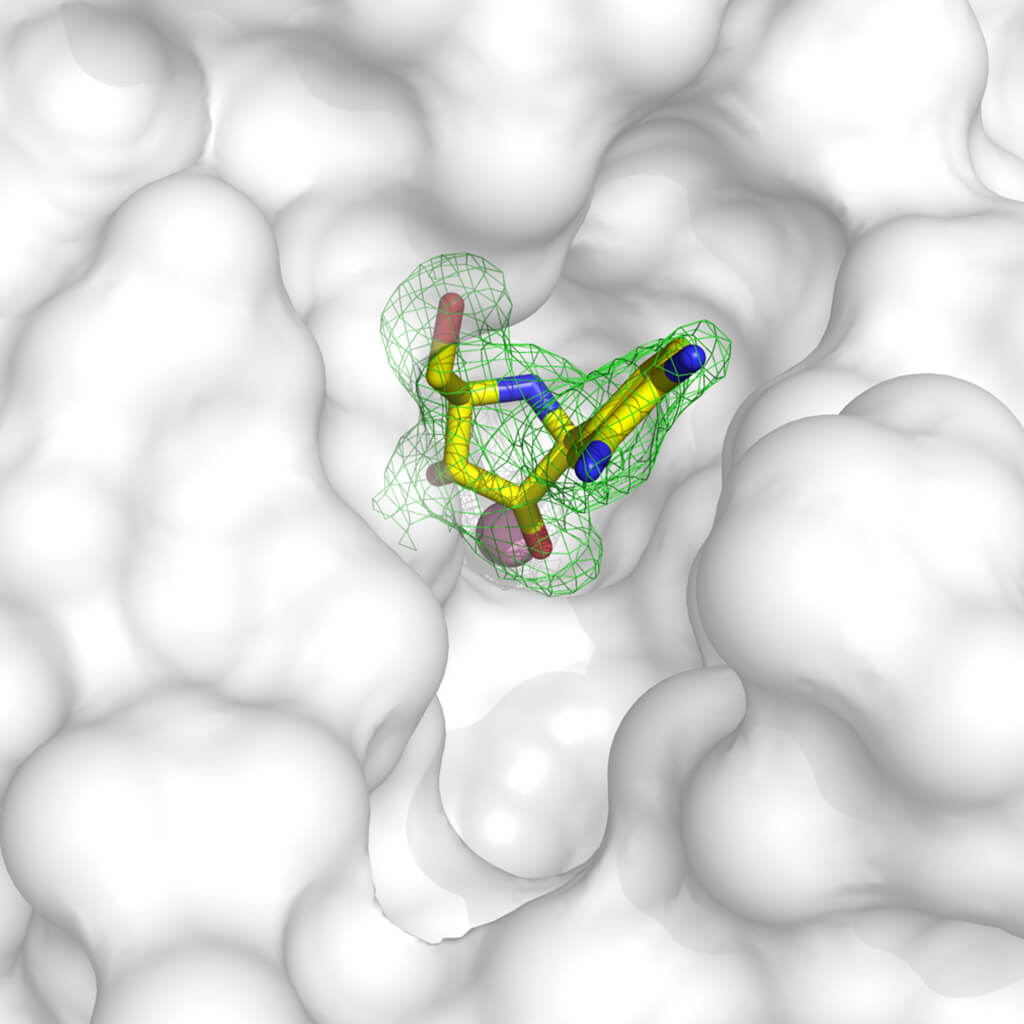
Кристаллография очень универсальна и является очень мощным инструментом для разработки направляющих соединений с перспективой их превращения в лекарственные средства. С помощью различных методологий можно получить структуру белков-мишеней, связанных с молекулами с ингибирующей активностью: фактически можно «пропитывать» кристаллы в растворе, в котором растворенное нами вещество может связываться с белком-«мишенью» или получать кристаллы белка после привязки к соединению. Как только структура белка, связанного с соединением, известна, мы можем визуализировать какие части белка (назовем их перчаткой) неправильно заполнены молекулой (пальцы руки). С помощью этой информации мы можем модифицировать молекулу ингибитора, чтобы она лучше связывалась с мишенью и блокировала ее функцию!
Пример ингибитора фермента, который был вставлен в молекулы кристалла. Плотность электронов (показана зеленым цветом – прим. ред.) четко определяет, где находится молекула в структуре белка (представлена белым). Можно заметить, что молекула не полностью занимает доступную полость, поэтому можно создать соединение, которое лучше дополняет структуру белка и эффективно