البيولوجيا الهيكلية لـ (SARS-CoV-2): علم البلورات بالأشعة السينية
تاريخ النشر : 07-08-2021
تحديث في : 16-05-2025
الموضوع: كوفيد-19
الوقت المقدر للقراءة : 1 دقيقة
أجبر جائحة كوفيد- 19 المستمرة المجتمع العلمي على تكريس نفسه للبحث والتطوير لاستراتيجيات مختلفة لمكافحة عدوى (SARS-CoV-2). الطريقة الوحيدة المعقولة للتعرف على مضادات الفيروسات الجديدة هي من خلال معرفة البنية ثلاثية الأبعاد أو شكل بروتينات الفيروس المسؤولة عن إصابة الخلايا وتكرار الفيروس. بمجرد معرفة بنية البروتينات، يمكن للكيميائيين تجميع المركبات التي تمنع وظيفتها، وبالتالي دورة حياة الفيروس.
نتحدث عن ذلك في هذه الدورة المكونة من 5 حلقات بمساعدة الدكتور ماسيمو ديجانو(Massimo Degano) ، قائد مجموعة وحدة البلورات الحيوية في مستشفى سان رافاييلي و أستاذ في جامعتنا.
لقد أوضحنا في المرات السابقة أنه من أجل تطوير عقاقير ضد (SARS-CoV-2)، من الضروري أن نعرف بطريقة مفصلة للغاية (دقة) بنية بروتينات الفيروس التي اخترناها كأهداف وفقًا لأهميتها في دورة حياة الفيروس. هذه هي مهمة البيولوجيا البنيوية، وقد شرحنا بالفعل مبدأ عمل المجهر الإلكتروني بالتبريد. التقنية الأولى التي جعلت من الممكن تصور اجسام الجزيئات ذات التفاصيل الذرية، والتي لا تزال توفر تفاصيل عالية جدًا، هي علم البلورات بالأشعة السينية.
نجاح (ومساهمات) التصوير البلوري بالأشعة السينية
تم تطوير النظرية البلورية بعد وقت قصير من اكتشاف فيلهلم رونتجن (Wilhelm Röntgen) للأشعة السينية، وذلك بفضل مساهمات ماكس فون لاو(Max von Laue) الحائز على جائزة نوبل في عام 1914 و ويليام هنري (William Henry)و ويليام لورانس براج (William Lawrence Bragg)(الأب والابن، وكلاهما من الفائزين بجائزة نوبل في عام 1915)، وعلى مر السنين تم صقلها وتحسينها باستمرار. في أيام هؤلاء الرواد، كان تحديد بنية الجزيئات الصغيرة مثل الأسبرين تحديًا هائلاً، ولكن بفضل أصحاب الرؤى مثل جون كيندرو (John Kendrew) و ماكس بيروتز Max) (Perutz ، كان من الممكن تحديد اجسام البروتين الأولى، الميوغلوبين و الهيموجلوبين. من عام 1945 إلى اليوم، قائمة نجاحات علم البلورات في تزويدنا بصور البروتينات ذات الأهمية الطبية الحيوية لا حصر لها، وتؤكد أهمية هذه المعلومات الأكاديمية الملكية السويدية للعلوم، التي تمنح بانتظام جائزة نوبل للدراسات الهيكلية التي تسمح لنا فهم عمل البروتينات المعقدة (https://www.iucr.org/people/nobel-prize).
استخدام الأشعة السينية لتصور بنية الجزيئات البيولوجية الكبيرة
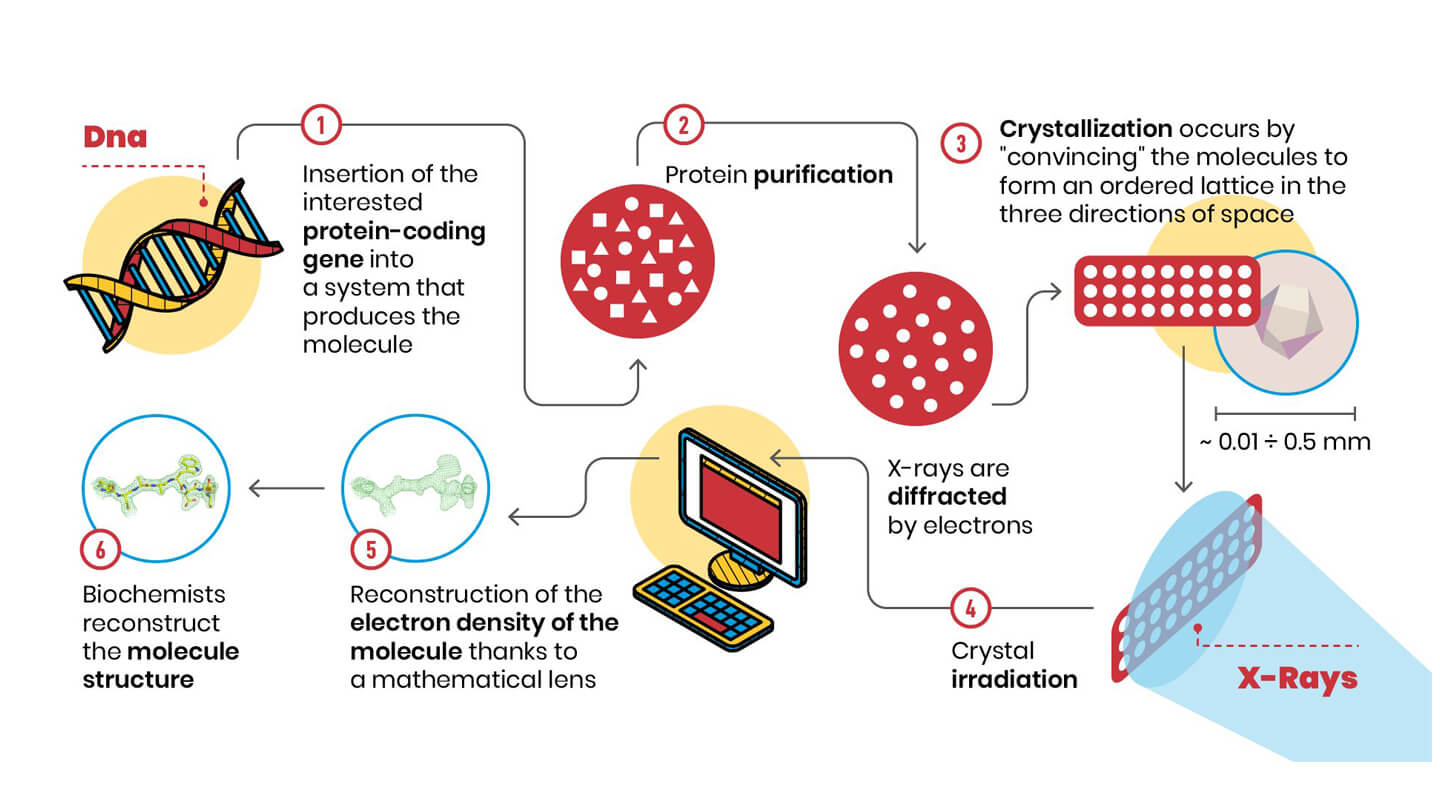
ما هي الخطوات في هذه التقنية؟ دعونا ننظر إلى المخطط:
1. أولا وقبل كل شيء، فمن الضروري أن يكون ملليغرام من عينة نقية، وهذا يعني كميات متناهية الصغر من الملوثات: في الممارسة العملية، العديد من الجزيئات متطابقة.
3. ثم يجب أن تشكل هذه الجزيئات بلورة ، أي شبكة ثلاثية الأبعاد مرتبة. هذه الخطوة أساسية ، لأن جزيئات البلورة موضوعة في أنماط من التناظر، مثل تلك التي درسها(M. C. Escher/https://mcescher.com/gallery/symmetry).
4. يتسبب ترتيب الجزيئات في البلورةفي تشتيت الإلكترونات حول الذرات عند تعرضها للأشعة السينية ، للإشعاع في الطور ، وتضاف مثل مكونات الجوقة الصوتية. يسمح لنا تأثير التضخيم هذا بقياس طيف الحيود، أي مواضع وشدة الأشعة السينية التي تحرفها جزيئات البلورة.
5. بمجرد إجراء هذا القياس، ومن خلال تطبيق نوع من العدسات الرياضية (يسمى «تحويل فورية العكسي»)، نحصل على خريطة كثافة الإلكترون التي تخبرنا كيف يتم ترتيب الذرات في البلورة. يمكن تصور كثافة الإلكترون على الكمبيوتر، ويجب إدخال مكونات الجزيء البيولوجي الذي ندرسه (الأحماض الأمينية للبروتينات وقواعد الريبوز والنيتروجين للحمض النووي والحمض النووي الريبي...) فيه، في مقبس يمكن أن يشبه بعض ألعاب الفيديو.
6. بعد الانتهاء من تفسير كثافة الإلكترون، أصبح لدينا أخيرًا الهيكل ثلاثي الأبعاد!
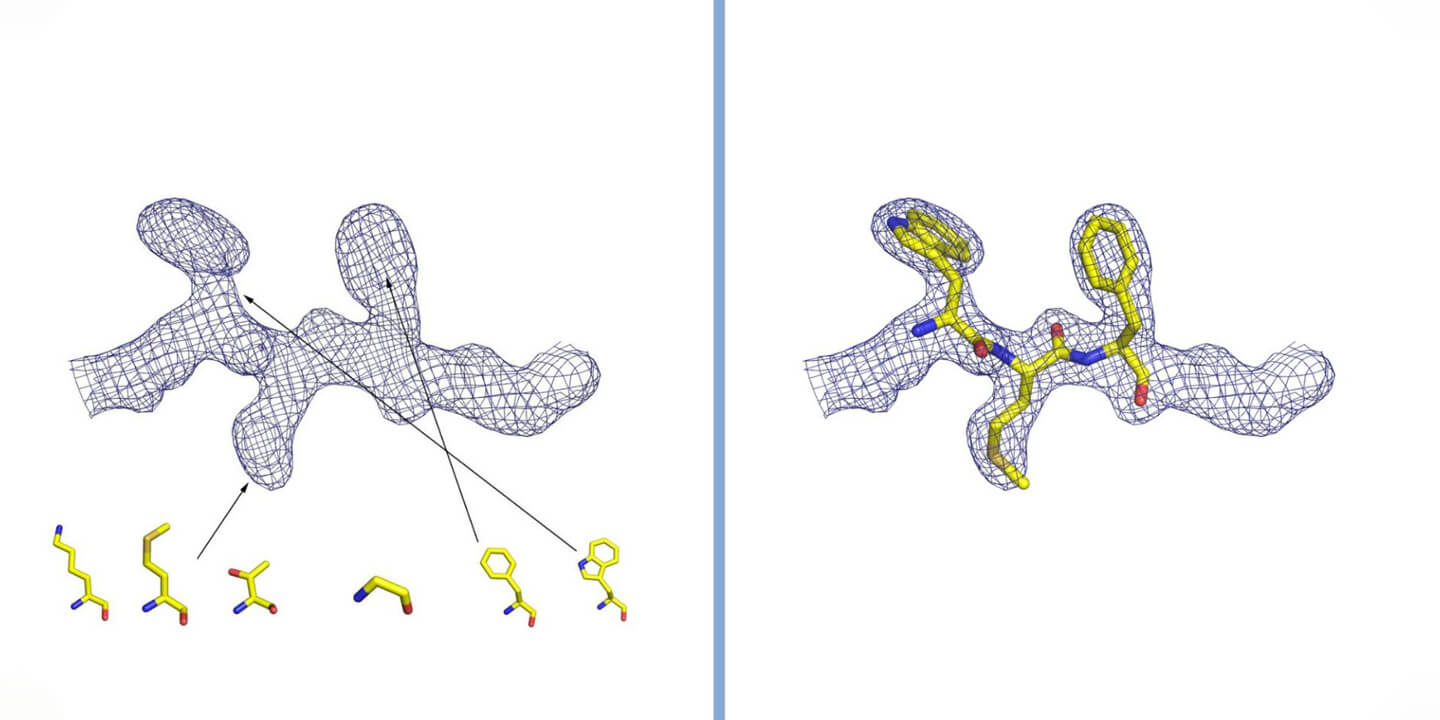
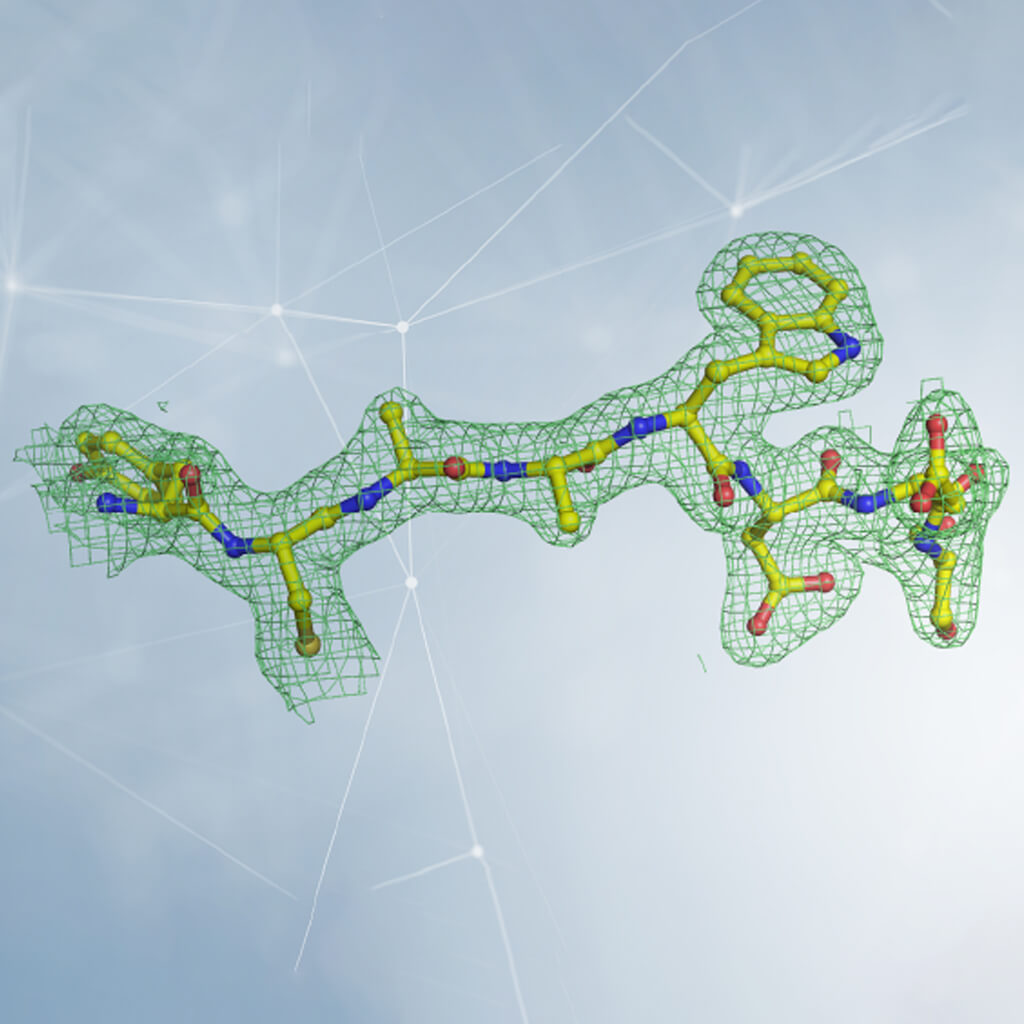
تفسير كثافة الإلكترون في علم البلورات. يتم تمثيل الكثافة بشبكة، توجد داخلها الذرات التي تشكل البروتين. في حالة البروتين، يتم ملاحظة شكل الكثافة ومقارنتها ببنية الأحماض الأمينية العشرين التي تشكلها (بعضها ممثلة في الشكل). عن طريق إدخال الأحماض الأمينية بالترتيب الصحيح واتباع اللف ثلاثي الأبعاد لكثافة الإلكترون، يتم إعادة بناء بنية البروتين. بإذن من الدكتور ديجانو(Degano).
استخدامات علم البلورات
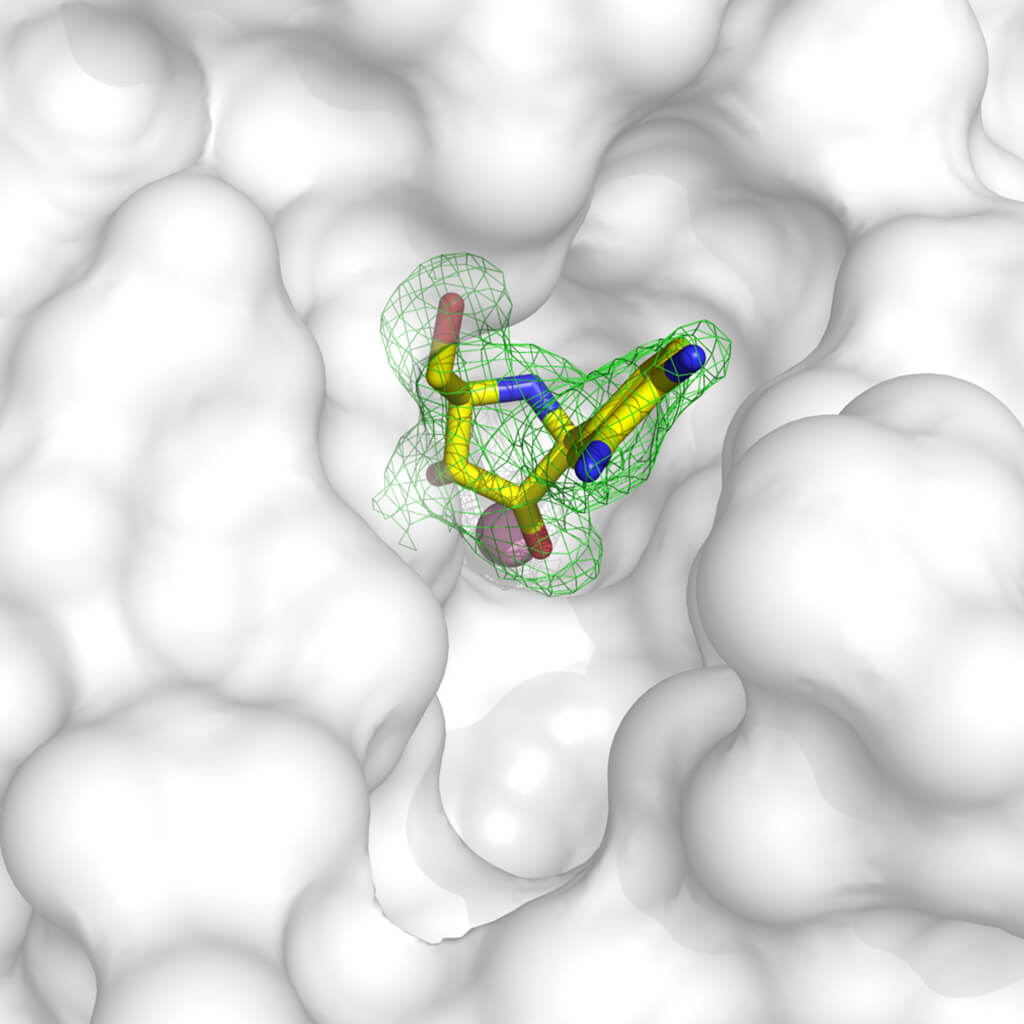
علم البلورات هو أداة متعددة الاستخدامات وقوية للغاية لتطوير المركبات الرئيسية التي لديها القدرة على أن تصبح أدوية. بفضل المنهجيات المختلفة، من الممكن الحصول على بنية البروتينات المستهدفة المرتبطة بالجزيئات ذات النشاط المثبط: في الواقع، من الممكن «غمس» البلورات في محلول يمكن أن ترتبط فيه المادة التي نعرف أنها مذابة بالبروتين المستهدف، أو للحصول على بلورات البروتين بعد ربطه بالمركب. بمجرد معرفة بنية البروتين المرتبط بالمركب، يمكننا تصورأي أجزاء من البروتين(والتي يمكننا مساواتها بالقفاز) لا يتم ملؤها بشكل صحيح بواسطة الجزيء. باستخدام هذه المعلومات، يمكننا تعديل الجزيء المثبط بحيث يتكيف بشكل أفضل مع هدفنا، ويمنع وظيفته!
مثال على مثبط الإنزيم الذي تم إدخاله في جزيئات البلورة. تحدد كثافة الإلكترون باللون الأخضر بوضوح مكان وضع الجزيء في بنية البروتين، ممثلة بالسطح الأبيض. يمكن ملاحظة أن الجزيء لا يشغل التجويف المتاح بشكل مثالي، لذلك من الممكن تصميم مركب يكمل بشكل أفضل بنية البروتين ويمنع وظيفته بشكل فعال. يمكن الوصول إلى الهيكل المستخدم باستخدام الرمز(3MKN) فيبنك بيانات البروتين. بإذن من الدكتور ديجانو (Degano).
