ARN polymérase : la "photocopieuse négligente" du SARS-COV-2

Date de publication: 14-08-2021
Mise à jour le: 16-05-2025
Sujet: Covid-19
Temps de lecture estimé: 1 min
Auteur d'articles
Eufemia PutortiRédacteur médical
Massimo Degano
Rédacteur et traducteur
Viktoryia LuhakovaLa pandémie de COVID-19 en cours a obligé la communauté scientifique à se consacrer à la recherche et au développement de diverses stratégies de lutte contre l'infection par le SARS-CoV-2. La seule façon avisée d'identifier de nouveaux antiviraux est la connaissance de la structure tridimensionnelle, littéralement la forme, des protéines du virus qui sont responsables de l'infection des cellules et de la réplication du virus. Une fois la structure des protéines connue, il est possible pour les chimistes de synthétiser des composés qui bloquent sa fonction, et par conséquent le cycle de vie du virus.
Nous en parlons dans ce cycle de 5 épisodes avec l'aide du Dr Massimo Degano, chef de groupe de l'unité de biocristallographie de l'hôpital IRCCS San Raffaele et professeur à notre université (il enseigne la chimie au cours de licence en dentisterie et implantologie dentaire et au MD Program international, la biochimie au cours de licence en médecine et la biologie structurelle au cours de licence en recherche biotechnologique en médecine).
Infection par le SARS-CoV-2 et son ARN polymerase
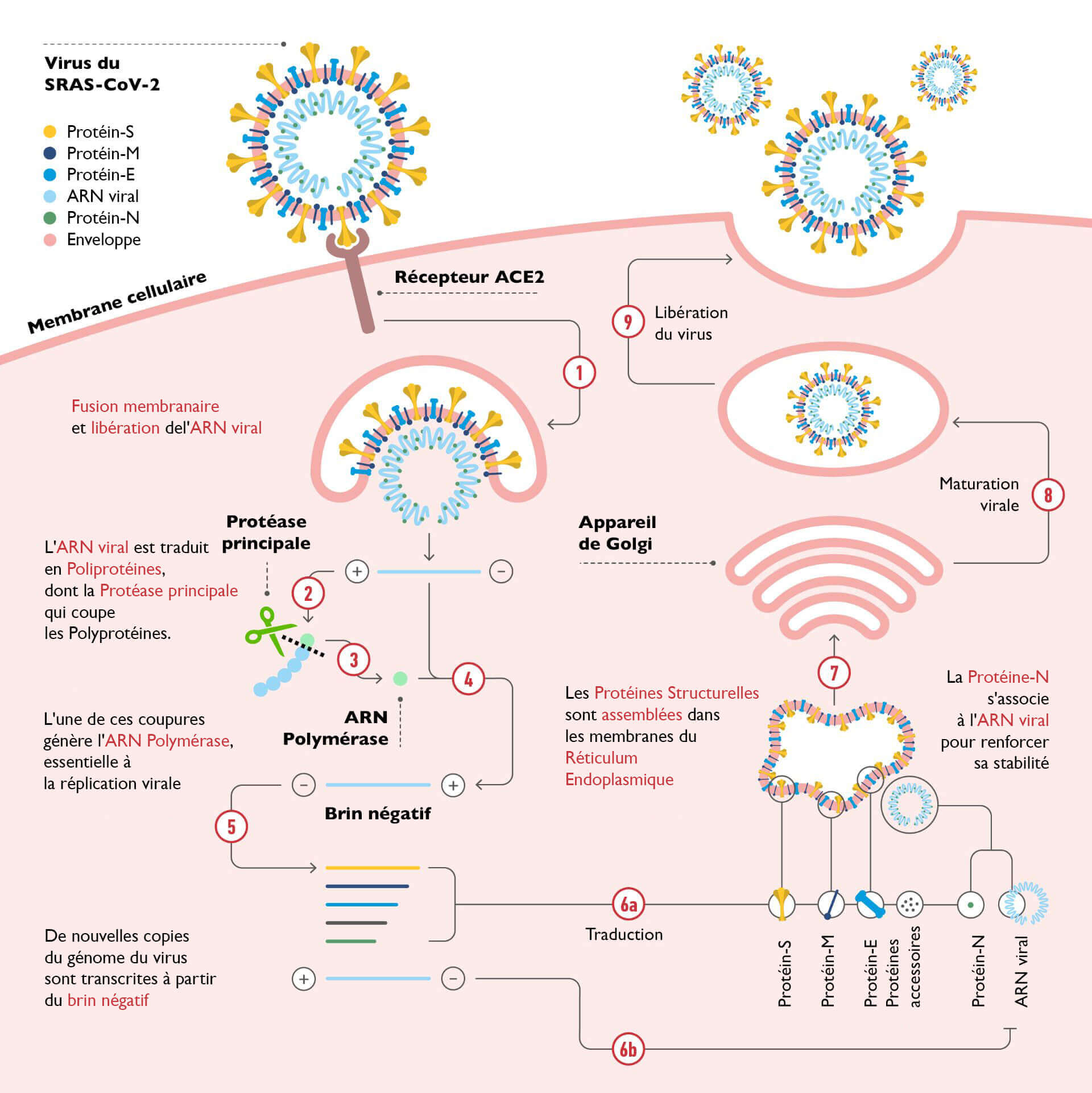
Comme nous l'avons vu précédemment, lors d'une infection virale, le virus pénètre dans la cellule hôte en s'accrochant d'abord à un récepteur viral (dans le cas du SARS-CoV-2, il s'agit de la protéine Spike) qui s'accroche à une protéine de la cellule cible (dans le cas du SARS-CoV-2, il s'agit de l'enzyme ACE2). Une fois à l'intérieur de la partie aqueuse de la cellule, appelée cytosol, le virus se "déballe" en libérant son contenu : un mélange de protéines et son matériel génétique. Alors que l'information génétique, c'est-à-dire ce qui est nécessaire pour construire les composants cellulaires, est stockée dans des molécules d'ADN chez l'homme, le coronavirus utilise une seule molécule d'ARN. Les humains ont également de l'ARN dans leurs cellules, mais nous l'utilisons à d'autres fins, principalement pour construire des protéines.

Une fois que le coronavirus a infecté une cellule, son but est d'assurer la formation de nouvelles copies du virus, afin d'avoir une descendance capable de perpétuer son espèce. Par conséquent, tout ce qui était présent dans le virus qui a infecté la cellule doit être "copié" et assemblé pour former de nouveaux virions, y compris de nouvelles copies du matériel génétique (= ARN) du virus lui-même. La machinerie essentielle à la synthèse de nouveaux ARN se trouve, sous différentes formes, dans tous les organismes et est appelée ARN polymérase, littéralement : "enzyme qui forme de longues chaînes d'ARN". L'ARN polymérase du SARS-CoV-2, appelée RdRP (ARN polymérase ARN-dépendante), copie essentiellement le matériel génétique du virus.
Une "photocopieuse négligente"
Bien qu'il s'agisse d'un processus sophistiqué et crucial, la machine (ou l'opérateur) est quelque peu "négligente" : en effet, chaque fois qu'elle fait une copie du matériel génétique original, elle commet des erreurs, et la copie présente des différences par rapport à l'original. Ces différences sont ce que l'on appelle des mutations, qui affectent la structure des protéines du virus et leur fonction. Ces derniers jours, nous avons entendu parler de la variante G614 (ou mieux, D614G) du virus : ce qui s'est passé, c'est que l'ARN polymérase a été "distraite" pendant qu'elle faisait une copie du génome viral, et elle a changé une base (une "brique") d'ARN. Cela a provoqué une mutation de la position 614 de la Spike protein, qui n'est toutefois pas un site de contact direct avec l'enzyme ACE2, de sorte que son effet sur la structure et la fonction devra être évalué expérimentalement pour comprendre ses conséquences. Dans tous les cas, ces mutations ont des conséquences sur le virus, c'est-à-dire qu'elles peuvent être neutres, avantageuses ou désavantageuses. Un virus muté commencera à circuler si cette mutation lui confère un avantage pour son cycle de vie : il peut s'agir d'être plus efficace pour infecter les cellules humaines, par exemple, mais de causer moins de dommages à l'organisme hôte ; en tant que virus hautement létal, il est destiné à disparaître par manque d'hôtes.
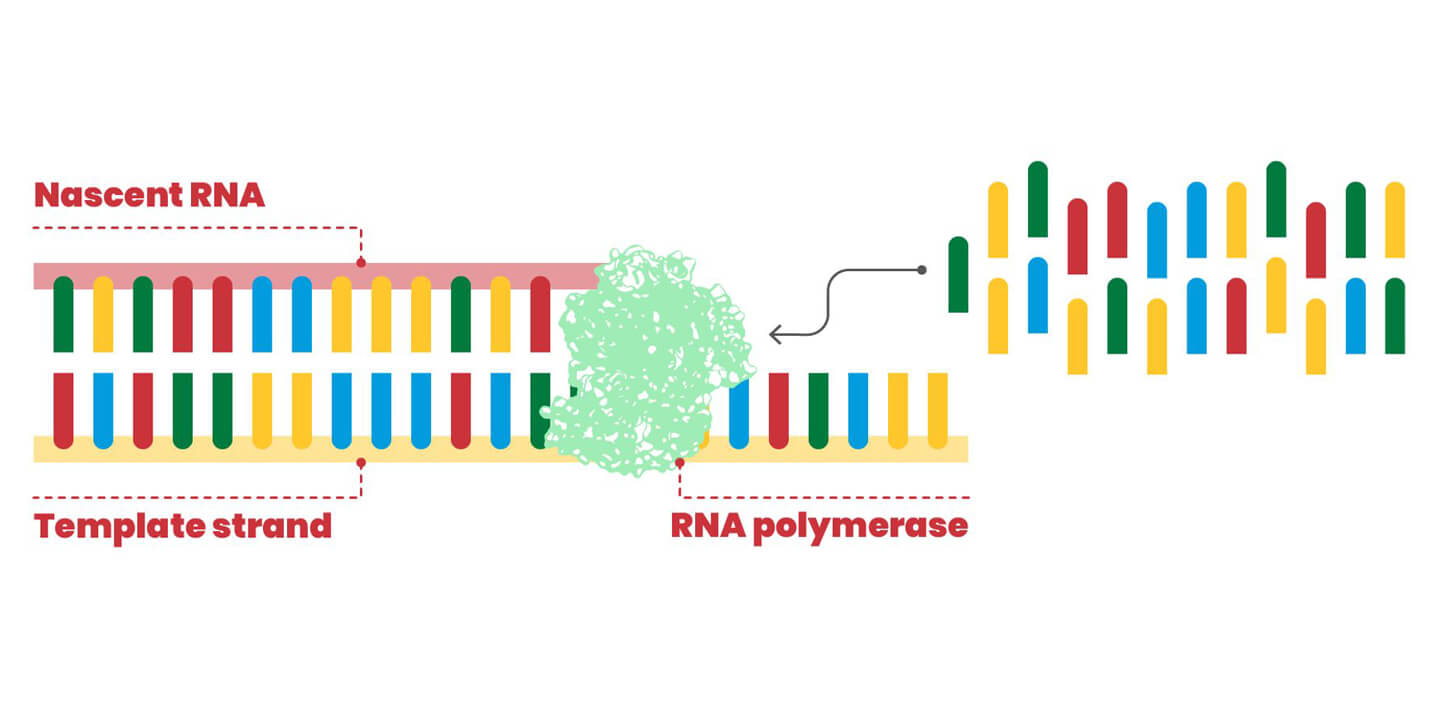
L'enzyme RdRP synthétise une copie du matériel génétique du virus, une molécule d'ARN composée de quatre bases azotées différentes. L'enzyme prend le brin d'ARN à copier et les unités moléculaires individuelles (nucléotides) qui lui sont complémentaires apparaissent une à une selon l'appariement A:U et G:C (dans la figure, les rectangles de couleurs différentes associent le jaune au bleu et le rouge au vert). Il arrive que le RdRP corresponde mal à ces briques, ce qui entraîne une mutation dans la "descendance" virale. Si la mutation est bénéfique pour la survie, elle sera maintenue.
L'antiviral Remdesivir
Revenons à la fonction première de l'ARN polymérase, c'est-à-dire copier le matériel génétique du SARS-CoV-2. Il s'agit d'une étape cruciale pour former un nouveau virus, et donc si nous pouvions bloquer l'action de la RdRP dans les cellules infectées... vous avez raison, le virus cesserait de se répliquer. Les molécules capables d'inhiber l'ARN polymérase sont d'excellents antiviraux ! La molécule Remdesivir, développée pour inhiber l'ARN polymérase du virus Ebola mais également capable de bloquer les polymérases d'autres virus, est un excellent exemple d'antiviral ciblant RdRP. À l'instar de ce qui a été observé pour la protéase principale Mpro du SARS-CoV-2, la biologie structurale peut nous dire comment le Remdesivir peut bloquer la machinerie et, surtout, elle suggère comment améliorer la molécule pour garantir l'obtention d'un antiviral hautement spécifique pour le coronavirus. Des chercheurs de l'Académie chinoise des sciences ont déterminé, à l'aide de la technique de la microscopie cryoélectronique, la structure de la RdRP, en la photographiant au milieu de son activité réplicative.
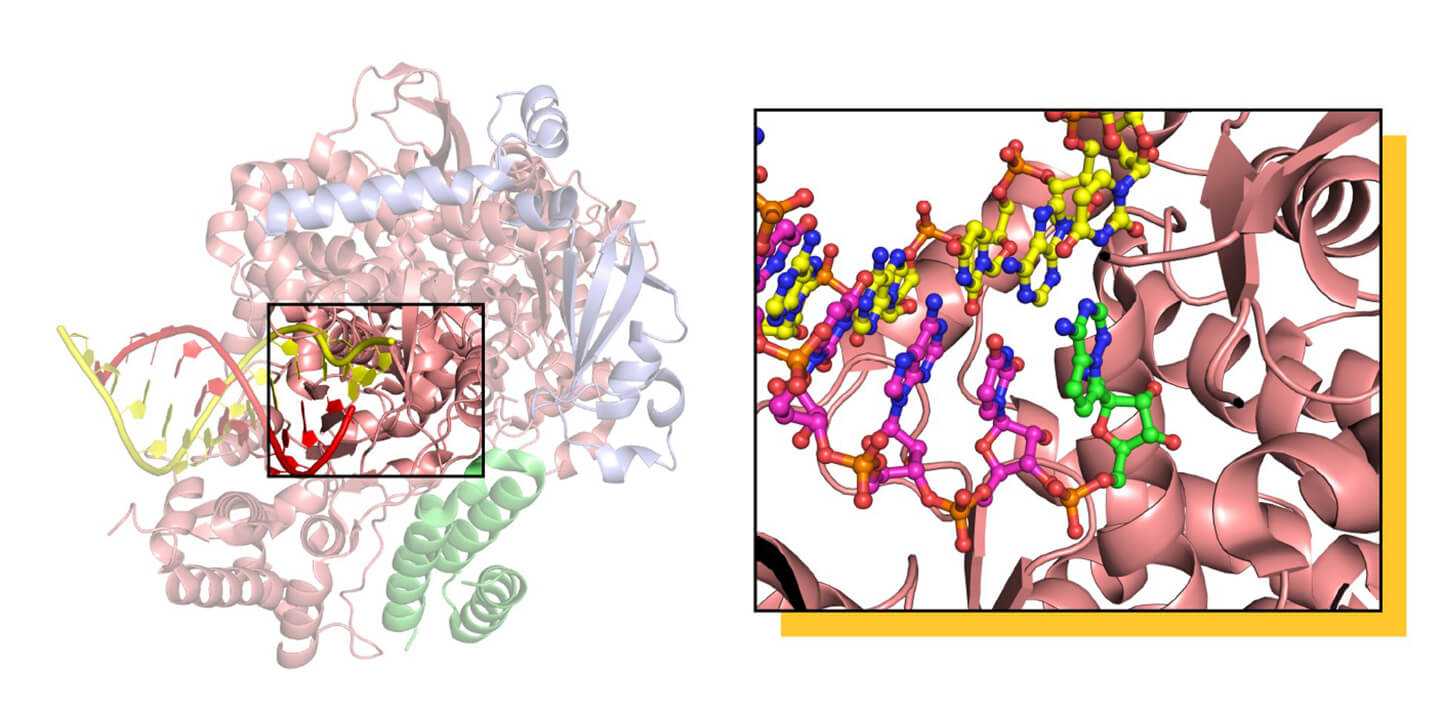
La structure de la RdRP du SARS-CoV-2, composée de trois sous-unités protéiques pour former un hétérotrimère actif, capturée par cryo-EM dans le processus de réplication de l'ARN, visible sur le côté gauche. Le cœur de la machine RdRP est mis en évidence sur la droite, où la forme active du médicament Remdesivir est affichée en vert, incorporée dans la copie du matériel génétique du virus. L'ajout du médicament à la copie de l'ARN empêche la copie complète du matériel génétique, et les détails précis du mécanisme font encore l'objet de débats. Avec l'aimable autorisation du Dr Degano.
Cette structure a montré que le Remdesivir agit d'une manière très particulière, non pas tant en bloquant la RdRP, mais en s'insérant dans la copie de l'ARN qui est créée et en y agissant comme un signal "stop", empêchant le travail de l'ARN polymérase de se poursuivre. Plus intéressant encore, la structure a montré que le point où le Remdesivir se lie à la RdRP avant d'être incorporé dans l'ARN présente des caractéristiques très spécifiques qui peuvent être utilisées par les chimistes pour synthétiser une molécule antivirale encore plus efficace. Deux autres structures déterminées par d'autres groupes dans des conditions différentes ont fourni d'autres informations sur le mécanisme d'action de l'antiviral et sur la manière d'en développer de meilleurs. À l'heure actuelle, il existe déjà un composé appelé EIDD-2801 qui est jusqu'à 10 fois plus puissant que le Remdesivir pour bloquer la réplication du SARS-CoV-2 dans des cellules en culture. Le chemin est encore long avant qu'un médicament soit disponible, mais grâce à la biologie structurelle, nous faisons de grands progrès.